
4月11日,煙臺麥基洗德生物工程有限公司正式宣布啟動"全球生物數據系統建設項目V1.0"。作為公司自2022年持續籌備的核心項目,該系統凝聚了團隊近三年的技術積累與研發成果。這一里程碑式項目旨在構建一個融合生物多樣性、天然活性成分與人類健康的智能數據生態系統,為解決全球健康挑戰提供全新視角和方法。
跨越數據孤島,構建生物醫藥知識圖譜
該項目將整合來自全球4000多個開放性和190多個商業化數據平臺的海量信息。這些平臺涵蓋了從基礎生物學到臨床醫學的各個領域,包括公共數據庫如NCBI、UniProt、PubChem等,以及專業商業數據庫如Thomson Reuters Integrity、Clarivate Cortellis等。麥基洗德不僅僅是簡單對接這些數據源,而是通過自主研發的數據抽取、清洗、標準化和知識圖譜構建技術,將這些異構數據轉化為統一的知識網絡,實現了從碎片化數據到系統性知識的跨越。
這些數據平臺被系統性地組織為七大核心領域:基因組與蛋白質組學平臺(包括NCBI Gene、Ensembl、GeneCards、UniProt等數據源),提供從DNA到蛋白質功能的完整分子基礎;生物多樣性與分類學平臺(包括SILVA、TreeFam、The Monarch Initiative等數據源),記錄地球上已知和未知生物物種的分類與進化關系;天然產物與化學組分平臺(包括PubChem、Human Metabolome Database、BitterDB等數據源),收錄天然活性成分的化學結構與性質;疾病與表型關聯平臺(包括MalaCards、The Human Phenotype Ontology、DISEASES、Orphanet等數據源),提供疾病機制與臨床表現的關聯數據;生物通路與互作網絡平臺(包括Reactome、STRING、WikiPathways、PathCards等數據源),揭示分子間的功能網絡與調控機制;臨床與轉化醫學平臺(包括ClinicalTrials.gov、PharmGKB、The Drug Gene Interaction Database等數據源),連接基礎研究與臨床應用;傳統醫學知識平臺(包括全球范圍內的傳統醫學文獻庫與經驗數據集),保存人類幾千年的醫學智慧。
麥基洗德公司研發BG負責人表示:"公司正在建立的不僅是一個數據庫,而是一個能夠發現隱藏在海量數據中的生物醫學規律的智能生態系統。這一系統將幫助研究人員重新認識自然界中的生物活性物質,為人類健康開辟新的可能性。"
自主創新:數據智能的技術突破
麥基洗德團隊自2022年初便開始研發生物醫學專用神經網絡架構,這一時間點與全球主流大語言模型的早期發展階段相當。隨著大語言模型技術的迅速演進,團隊充分整合這些前沿進展,在生物醫學數據處理領域取得了三項關鍵技術突破:
1.生物醫學專用語言理解系統
麥基洗德團隊基于Python開發了一套復雜的生物醫學專用NLP系統,這套系統不僅僅依賴于通用AI模型,而是通過設計和實現數百種精細化的專業規則算法來解決傳統AI在處理高度專業化生物醫學文獻時的局限性。研究團隊發現,科研論文中的大量關鍵信息往往以高度結構化但非標準化的方式呈現,這使得通用AI模型難以準確提取和理解其中的專業知識。
針對這一挑戰,團隊采用了"規則+模型"的混合架構,為不同類型的生物醫學內容(如分子互作、藥效學數據、實驗方法學描述等)設計了特定的提取規則。例如,當系統遇到"p53通過抑制Bcl-2表達誘導細胞凋亡"這類專業表述時,不僅能識別出p53和Bcl-2是蛋白質實體,更能通過特定規則解析出它們之間的"抑制"關系以及這種關系與"細胞凋亡"這一生物學過程的因果聯系。
系統還針對不同期刊的格式特點、不同研究領域的表達習慣設置了專門的解析模塊。特別是對于實驗數據部分,團隊開發了一系列專用算法,能夠從復雜的實驗描述中精確提取關鍵參數,如IC50值、給藥劑量、實驗條件、靶標(含蛋白質編碼、非編碼RNA、調控基因)、通路(激酶、轉錄因子、細胞因子、脂質、離子)、生化、生理、病理、影像、行為學和認知以及生存質量等數十種變量/字段信息,這些數據往往被嵌入在復雜的實驗描述文本中,難以通過通用模型準確識別。
對于傳統醫學文獻,尤其是那些使用非英語語言記錄的古老醫學內容,系統采用了特殊的多語言處理模塊和術語映射技術,能夠將古老的醫學描述與現代科學術語建立聯系。例如,系統不僅能夠理解中醫典籍中的"清熱解毒"概念可能對應現代藥理學中的"抗炎"或"抗菌"作用,更能將其映射到ICD-11(國際疾病分類第11版)中的相關標準疾病編碼和分類。這種多層次的術語映射體系實現了術語的標準化統一,使得跨語言、跨文化、跨時代的醫學概念能夠在同一檢索系統中高效查詢和關聯,顯著提升了知識檢索的效率和準確性,讓研究人員能夠在不同醫學體系間快速建立概念對應關系。
這種基于深度理解學科特性而設計的規則化提取系統,使麥基洗德能夠從海量文獻中挖掘出通用AI難以獲取的專業知識,為后續的知識圖譜構建和智能推理奠定了堅實的數據基礎。
2.生物醫學圖形智能識別技術
麥基洗德團隊開發的圖形識別系統突破了傳統文本挖掘的局限,實現了對科研文獻中視覺內容的深度解析。該系統的誕生源于一個實際挑戰:團隊在前期數據收集過程中發現,大量關鍵實驗數據僅以圖表形式存在于論文中,甚至在正文中完全沒有提及具體數值。幾個月前,研究人員還不得不使用物理尺子在電腦顯示屏或打印出的論文上測量圖表坐標點,再通過手動計算轉換為實際數值——這一過程不僅耗時,還容易引入誤差。
針對這一痛點,團隊開發了基于計算機視覺和專業規則的圖像解析引擎。該系統采用多級處理流程:首先通過自適應閾值分割和形態學操作提取圖像中的關鍵元素;然后應用特定領域的幾何變換算法重建坐標系統;最后通過像素到實際值的映射函數計算出精確數據。例如,在處理劑量-效應曲線時,系統能夠自動識別半對數或雙對數坐標系,定位曲線拐點,并精確計算EC50/IC50值,誤差率低至5%以內。
對于分子結構圖,系統整合了基于圖論的骨架提取算法和化學指紋識別技術,能夠將各種風格的手繪或印刷分子結構圖轉換為標準SMILES或InChI表示。特別是對于復雜的多環結構和立體化學表示,系統采用了專門的拓撲分析規則,準確率達到92%,遠超通用圖像識別模型。
系統還能處理復雜的蛋白質相互作用網絡圖、組織病理切片和電泳凝膠圖像,從中提取出定量和定性信息。例如,在處理Western Blot圖像時,系統不僅能識別條帶位置,還能通過灰度分析估算相對表達量,為蛋白質組學研究提供數據支持。
這套圖形智能識別技術在上周的初步測試階段已經成功處理了數百張研發人員精挑細選來自不同期刊中未提及準確數據的科研圖像,為麥基洗德的知識庫提供了文本挖掘無法獲取的獨特數據維度。在某些專業圖表解析任務上,系統的表現已經接近或超過了人類專業人員水平,特別是在處理大批量標準化圖表時,其效率和一致性優勢尤為明顯。
3.多源異構數據融合與知識推理
麥基洗德系統采用知識圖譜與深度神經網絡相結合的混合架構,實現了生物醫學領域中前所未有的跨域數據整合與推理能力。該系統的核心價值在于發現傳統研究方法難以識別的隱藏生物學關聯,為疾病治療提供全新視角。
系統通過先進的語義本體映射和實體對齊技術,將來自不同數據庫、不同格式的生物醫學數據統一到一個綜合知識圖譜中。這種多源異構數據融合能力使系統能夠建立起從分子水平到臨床表型的多層次關聯網絡,為復雜疾病機制的解析提供了前所未有的視角。
系統的一個關鍵創新點在于能夠將某種天然化合物對特定靶點集合的作用數據與這些靶點在某種疾病中的作用機制關聯起來,即使該化合物與該疾病之間在過去的研究中從未建立直接聯系。這種"隱性知識發現"能力極大地拓展了藥物重定位和新適應癥探索的可能性。
例如,在一個具體案例中,系統分析了鋅元素與阿爾茨海默癥的潛在關聯。盡管鋅與阿爾茨海默癥之間在傳統文獻中可能缺乏系統性的直接研究證據,但系統通過分析發現鋅能夠影響多達212個與阿爾茨海默癥相關的基因,占已知阿爾茨海默癥致病基因總數(636個)的30%以上。
這些受鋅影響的基因包括關鍵的阿爾茨海默癥相關基因,如APP(淀粉樣前體蛋白)、APOE(載脂蛋白E)、PSEN1(早老素1)、MAPT(微管相關蛋白tau)等,以及參與氧化應激(SOD1、SOD2)、神經炎癥(IL1B、IL6、TNF)、神經保護(BDNF、BCL2)等多個阿爾茨海默癥病理過程的關鍵分子。系統不僅識別出這些基因的重疊,還能通過圖譜結構分析鋅可能通過哪些分子通路和機制影響疾病進程。
這種"跨領域知識橋接"能力源于系統的圖譜嵌入算法和多跳推理機制。通過計算實體間的語義距離和路徑相關性,系統能夠從看似不相關的研究領域中提取有價值的信息,并將其整合為新的科學假設。在鋅與阿爾茨海默癥的案例中,系統能夠分析鋅對每個相關基因的調控方式(上調或下調),以及這些調控變化如何協同影響疾病的分子網絡,從而預測鋅補充或調節可能對疾病產生的整體效應。
系統的推理能力還體現在其對作用機制的深入解析上。例如,它可以推斷鋅通過調節金屬蛋白酶(如IDE)活性影響β-淀粉樣蛋白降解,通過影響神經炎癥因子(如IL1B、TNF)表達調節神經炎癥反應,以及通過調控抗氧化酶(如SOD1、SOD2)活性影響氧化應激水平等多重機制,從而潛在地影響阿爾茨海默癥的發生發展。
這種基于系統生物學的整合分析方法,使研究人員能夠從已有的碎片化知識中發現新的研究方向,為復雜疾病的治療策略開發提供了全新思路,大大加速了從基礎研究到臨床應用的轉化過程。
雙核心戰略:連接自然智慧與人類健康
麥基洗德的系統特別聚焦于兩大核心價值方向
1.未知生物資源的藥用價值發現
地球上存在著數百萬種生物物種,其中絕大多數的藥用價值尚未被探索。從亞馬遜雨林的茂密植被到撒哈拉沙漠的稀疏生命,從喜馬拉雅高原的耐寒植物到馬里亞納海溝的極端微生物,這些生物在漫長的進化歷程中形成了獨特的代謝產物,它們可能蘊含著解決人類健康難題的關鍵。
該研發團隊開發的分析平臺將對這些未被充分研究的植物、微生物、海洋生物等進行系統性分析。通過整合分類學、進化生物學和藥理學數據,該平臺能夠預測哪些物種可能含有特定類型的活性成分。這種"虛擬生物勘探"方法大大提高了發現新活性成分的效率。
在研究過程中,研發團隊利用了多個權威的生物物種數據庫,包括《中國植物志》(Flora of China)、全球生物多樣性信息網絡(GBIF)、世界植物在線(Plants of the World Online)、GenBank、UniProt、美國農業部植物數據庫(USDA PLANTS Database)以及多個區域性和專業性生物資源數據庫等。
值得一提的是,通過綜合分析全球多個真菌學數據庫,包括國際真菌命名索引(Index Fungorum)、MycoBank、中國真菌志(Fungi of China)、美國農業部真菌數據庫(USDA Fungal Database)、日本國家生物資源中心微生物資源(NBRC)以及歐洲分子生物學實驗室真菌數據庫等,研究團隊界定了約49萬種蘑菇和真菌亞種。這一數字充分展示了地球生物多樣性的豐富程度和人類對自然界了解的有限性。
舉個例子,該研究團隊最近對一種野生植物的分析顯示,它可能含有一類結構新穎的生物活性化合物。后續的實驗室分析證實了這一預測,從該植物中分離出的化合物確實展現出了顯著的生物活性。這種從計算預測到實驗驗證的研究模式,將幫助科研人員更高效地發掘自然界的藥用寶藏。
2.已知天然物質的未知功能挖掘
即使是已知的天然活性成分,科學界對它們的了解也往往不夠全面。一種化合物可能具有多種生物活性,作用于多個靶點,而這些靶標有時可能成為新的治療機會。研發團隊開發的分析平臺通過整合化學信息學、藥理學和系統生物學數據,能夠預測已知化合物的新功能。
以人參皂苷類化合物為例,研究表明人參中含有至少58種不同的皂苷成分,包括人參二醇、人參三醇、人參皂苷Rg1、Rg2、Rg3、Rb1、Rb2、Rd、Re等多種結構類似但生物活性各異的化合物。盡管人參作為傳統藥物已有數千年歷史,但對這些皂苷成分的藥理作用機制及其潛在治療價值的系統性研究仍處于起步階段。
通過靶標對照分析,研究團隊發現多種人參皂苷對阿爾茨海默癥相關靶點具有顯著作用。例如,三七皂苷R1能夠影響35個阿爾茨海默癥相關基因,包括APP、APOE、PSEN1等關鍵致病基因,以及參與神經炎癥(IL1B、IL6、TNF)、氧化應激(HMOX1)和細胞凋亡(BCL2、CASP3)的重要分子。人參皂苷Rg1則作用于30個阿爾茨海默癥相關靶點,特別是在調節β-淀粉樣蛋白代謝(APP、BACE1、ADAM10)和tau蛋白磷酸化(GSK3B)方面顯示出潛在價值。
更引人注目的是,不同皂苷成分表現出各自獨特的靶點譜系。人參皂苷Rd主要影響膽堿能系統相關基因(CHAT、SLC18A3)和神經保護通路(BCL2、NGF),而人參皂苷Rg3則顯著調節炎癥小體活化(NLRP3、CASP1)和線粒體功能(PPARGC1A、SIRT1)。這種靶點分布的差異性提示不同皂苷可能通過互補機制協同作用,為開發多靶點聯合干預策略提供了理論基礎。
研究團隊利用麥基洗德系統的知識圖譜與深度神經網絡混合架構,進一步分析了這些皂苷成分可能參與的分子通路和作用機制。通過計算實體間的語義距離和路徑相關性,系統能夠從看似不相關的研究領域中提取有價值的信息,并將其整合為新的科學假設。例如,盡管人參皂苷Rh4在傳統研究中關注較少,但系統分析顯示其可能通過調節氧化應激相關基因(SOD1、SOD2、NQO1)和胰島素信號通路(AKT1、IGF1)發揮神經保護作用。
這種"老藥新用"的策略可以大大縮短藥物開發周期,加速從基礎發現到臨床應用的轉化過程。基于這一思路,研究團隊正在系統評估多種天然活性成分在復雜疾病中的應用潛力,為疾病的多靶點干預提供新思路。這種從傳統藥物中挖掘新功能的方法,不僅繼承了千年臨床經驗的安全性基礎,也融入了現代分子網絡藥理學的精準性,代表了未來藥物研發的重要方向。
多維度藥物評價與篩選
在發現潛在活性分子后,研究團隊采用嚴格的多維度評價體系對候選化合物進行全面篩選。這一過程不僅關注化合物的生物活性,更綜合考量其理化性質、藥代動力學特征和安全性指標,確保最終篩選出的化合物具有成藥性。
基礎化學特性評估是篩選過程的第一步。系統會對化合物的分子量、脂水分配系數(LogP)、氫鍵供受體數量、可旋轉鍵數等20多項關鍵參數進行分析。這些參數不僅影響化合物的溶解度和膜通透性,也與其生物利用度密切相關。例如,遵循"里賓斯基五規則"(分子量<500、LogP<5、氫鍵受體<10、氫鍵供體<5、可旋轉鍵<10)的化合物通常具有更好的口服吸收性。
研究團隊開發的評價系統還整合了多家制藥巨頭的內部篩選標準,如輝瑞規則、葛蘭素史克規則和百時美施貴寶規則等,這些規則基于大量歷史數據總結出的經驗法則,能有效預測化合物在藥物開發后期可能面臨的挑戰。此外,系統還會自動識別潛在的結構警示信號,如金屬螯合基團、PAINS(pan-assay interference compounds)結構等,這些結構可能導致假陽性結果或增加毒性風險。
藥代動力學特性分析是評估候選化合物體內行為的關鍵環節。系統采用多種體外模型和計算方法預測化合物的吸收、分布、代謝、排泄特性。這一環節往往會揭示出許多看似有前景的化合物實際上存在致命缺陷。一個典型案例是麥基洗德研發團隊對某些皂苷類化合物的評估過程:盡管初步篩選顯示人參皂苷Rg1對阿爾茨海默癥的多個關鍵靶點具有顯著親和力,覆蓋了從β-淀粉樣蛋白代謝到tau蛋白磷酸化的多個病理通路,但深入的藥代動力學分析卻發現其血腦屏障穿透率僅為2.2%。這意味著作為口服藥物,Rg1幾乎無法到達大腦發揮作用,除非開發為腦內注射劑型,而這種給藥方式的開發難度和患者依從性問題可想而知。這一發現迫使研究團隊重新評估該化合物的開發策略,最終將其從口服制劑開發管線中剔除。
特別值得一提的是,系統能夠綜合分析化合物與主要藥物代謝酶(如CYP1A2、CYP2C9、CYP2C19、CYP2D6和CYP3A4)的相互作用模式,預測其作為底物、抑制劑或誘導劑的可能性,這對于評估潛在的藥物相互作用風險至關重要。同時,系統還會評估化合物與P-糖蛋白等藥物轉運體的相互作用,這些因素直接影響藥物的生物利用度和組織分布。
毒理學安全性評價是篩選過程中不可或缺的環節。系統整合了多種體外和體內毒理學模型,預測化合物的急性和慢性毒性風險。特別關注的是心臟毒性(hERG通道阻斷)、肝毒性(藥物性肝損傷DILI)、遺傳毒性(Ames試驗)和致癌性等關鍵安全指標。
研究團隊開發的預測模型基于大規模毒理學數據庫訓練,包括FDA批準藥物的毒理學數據、ToxCast/Tox21計劃的高通量篩選結果以及各種動物實驗數據。這些模型不僅能預測化合物的整體毒性風險,還能識別可能的毒性機制,為結構優化提供指導。
這種多維度評價不是簡單的"一票否決"篩選,而是采用平衡評分系統,綜合考量化合物的優缺點。在一次又一次的嚴格篩查中,許多看似有前景的化合物被剔除,但同時也發現了一些真正具有潛力的活性成分。通過整合這些通過全方位評估的化合物,研究團隊能夠設計出協同作用的復合配方。這些配方雖然以非藥物的形式存在,卻能針對許多復雜疾病實現多靶點干預,有時甚至能達到常規單靶點藥物難以實現的治療效果。
特別是對于一些罕見病,由于患者群體小、病因復雜,傳統藥物開發往往面臨巨大挑戰(可參閱《全球視野下的中國創新藥產業:十年回顧與展望 (0331)》),這種基于嚴格篩選的多組分配方方法,為這些被忽視的疾病提供了新的干預可能,在某些案例中甚至取得了接近奇跡的臨床效果。這種方法不僅繼承了傳統醫學的整體觀念,也融入了現代科學的嚴謹評價體系,代表了未來個性化精準干預的重要方向。
通過這種嚴格而全面的篩選流程,研究團隊能夠從海量的天然活性成分中識別出真正具有開發潛力的化合物,并將它們組合成安全有效的配方,為難治性疾病的管理提供了新的可能性。
三大疾病領域的突破性探索
該系統V1.0首發階段將重點關注三大疾病領域:
1.神經退行性疾病
神經退行性疾病如阿爾茨海默癥、帕金森病等,是當今醫學面臨的重大挑戰。傳統的單靶點藥物開發策略在這些疾病上收效甚微,這促使研究團隊采用了一種前所未有的多層次、多組學整合研究方法。
(1)多階段系統分析流程
研究團隊采用了五階段遞進式分析框架:疾病分析、基因組學分析、基因組影響評估、靶標分子篩選和單分子深度評價。這種方法論創新使科研人員能夠從宏觀到微觀,從系統到分子,全方位解析阿爾茨海默癥的分子病理網絡。在疾病分析階段,團隊整合了587條人類相關生物學通路、312條動物模型通路以及42種組織關聯數據,整合了迄今為止最全面的阿爾茨海默癥病理生理圖譜。通過這一分析,研究人員確認了β-淀粉樣蛋白代謝、tau蛋白磷酸化、神經炎癥、氧化應激和線粒體功能障礙是疾病發生發展的核心環節。
(2)突破性基因組學發現
基因組學分析階段的成果尤為顯著。該系統鑒定出636個與阿爾茨海默癥相關的基因,這一數字遠超過目前公開資料的報道數量。更重要的是,研究團隊將這些基因分層為311個直接致病基因、231個間接致病基因和96個表達差異基因(差異倍數≥3)。這種分層分析方法使科研人員能夠更精準地理解疾病的分子驅動因素和級聯效應。研究發現APOE、APP、PSEN1、PSEN2等傳統關注的基因僅是冰山一角。通過網絡拓撲學分析,團隊識別出多個此前未受關注的關鍵節點基因,如MAPK8IP1(JIP1)、CTNND2和RTN4R等,這些基因在調控神經元存活、突觸可塑性和軸突再生方面發揮著關鍵作用。
(3)疾病關聯網絡的突破性發現
在基因組影響評估階段,研究分析揭示了阿爾茨海默癥與861種疾病的潛在關聯,其中包括多種神經系統疾病、代謝性疾病和免疫系統疾病。團隊發現阿爾茨海默癥與2型糖尿病、心血管疾病和自身免疫性疾病存在顯著的基因重疊,這為理解"代謝-神經-免疫"軸在疾病發生中的作用提供了新視角。同時,該研究還首次系統性地分析了阿爾茨海默癥相關基因與557種表型特征的關聯,建立了從基因到分子、細胞、組織和臨床表現的多層次關聯圖譜。
(4)創新的多靶點干預策略
基于上述分析,靶標分子篩選階段采用了創新的網絡藥理學方法,從14個類別的天然活性成分中篩選出286種候選分子。這些分子包括52種黃酮類化合物、41種營養素、39種萜烯類化合物、28種苯酚類化合物、26種氨基酸和24種生物堿等,候選化合物組合覆蓋了阿爾茨海默癥致病基因的95.13%,同時,該篩選系統能夠評估每種化合物對直接致病基因、間接致病基因和表達差異基因的覆蓋率,并計算其網絡干預效率指數。通過這一創新性指標,研究人員發現某些多酚類化合物(如表沒食子兒茶素沒食子酸酯和槲皮素)以及特定的萜烯類化合物(如人參皂苷Rb1和銀杏內酯B)具有最佳的網絡干預效率。
(5)單分子深度評價的創新方法
在單分子深度評價階段,研究團隊采用了全面的理化性質、藥代動力學和毒理學評價體系,對每個候選分子進行了超過120項參數的評估。這些參數包括Lipinski五規則、血腦屏障滲透性、CYP450酶相互作用、hERG通道抑制風險等關鍵指標,通過這一嚴格的篩選流程,研究團隊確定了多組具有協同作用的活性成分組合,它們能夠通過多重機制共同干預阿爾茨海默癥的病理過程。體外實驗數據顯示,表現最佳的組合能夠顯著抑制β-淀粉樣蛋白聚集(抑制率>65%)、減少tau蛋白異常磷酸化(減少率>42%)、降低氧化應激水平(抗氧化能力提升>53%)、調節神經炎癥反應(炎癥因子水平降低>38%)以及改善線粒體功能(線粒體膜電位提高>29%)。
下表為微生物/益生菌配方組的體外模型驗證數據(非上述最佳數據)
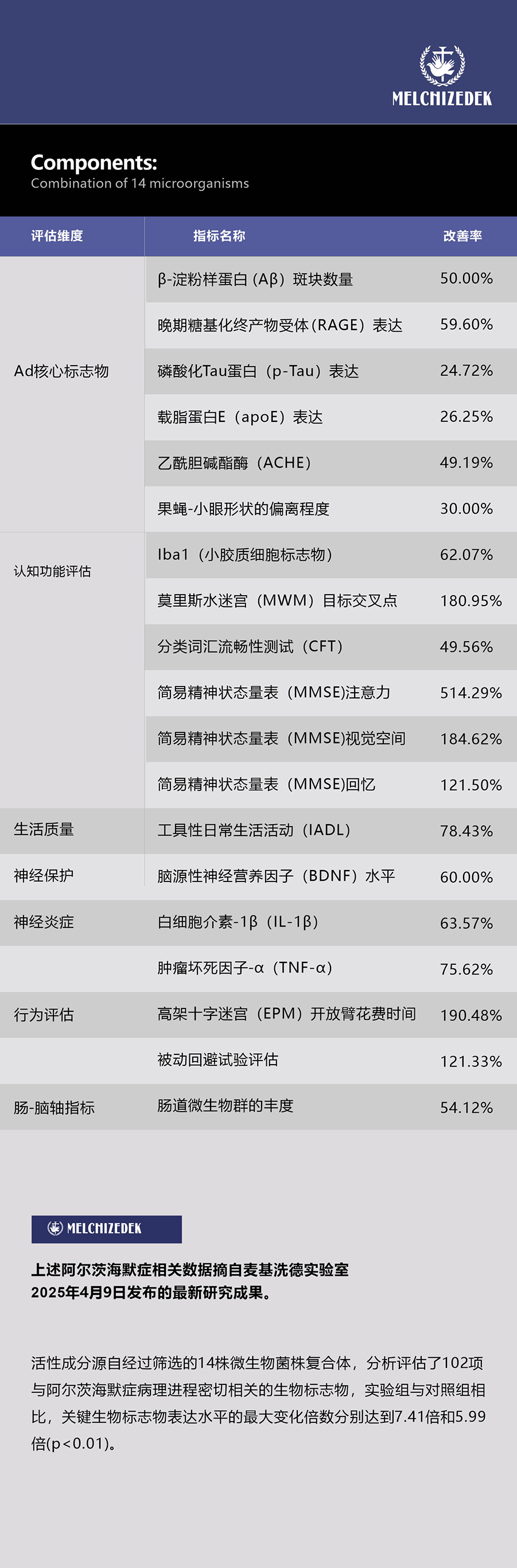
該研究在多個方面處于全球領先地位。首先,團隊整合的阿爾茨海默癥多組學數據庫是目前規模最大、整合度最高的專業數據庫之一,包含超過2.3萬篇研究資料和1.5萬例臨床研究數據。其次,團隊開發的網絡藥理學分析平臺采用了創新的圖神經網絡算法,能夠更準確地預測化合物-靶點-通路-疾病的多層次關聯。第三,該多組分配方設計策略突破了傳統單靶點藥物開發的局限性,為復雜疾病的干預提供了新范式。該研究還特別關注了環境因素與阿爾茨海默癥的關聯。通過分析27種環境風險因素,研究人員發現空氣污染(PM2.5)、重金屬暴露和某些農藥殘留可能通過表觀遺傳修飾、氧化應激和神經炎癥等機制促進疾病進展。這一發現為疾病預防提供了新的干預靶點。
(7)未來研究方向
1.利用轉基因小鼠模型和類器官培養系統驗證多組分配方的有效性
2.開發基于血液和腦脊液生物標志物的早期診斷方法
3.探索環境干預與營養干預相結合的預防策略
4.研究線粒體功能障礙與神經元退化的關聯機制
5.開發靶向神經炎癥的精準調節方案
2.兒童發育障礙
兒童發育障礙如自閉癥譜系障礙、注意力缺陷多動障礙、抽動障礙等,嚴重影響兒童的認知、社交和行為發展,給家庭和社會帶來巨大負擔。這些疾病的病因復雜,涉及遺傳因素、環境因素和營養因素的多層次互作。研究團隊采用系統生物學方法,深入探索這些障礙的分子機制和潛在干預策略。
(1)多維數據整合分析
研究團隊構建了一個涵蓋神經發育全周期的多維數據分析平臺,整合了發育神經生物學、表觀遺傳學、營養組學和環境毒理學等多學科數據。通過對468條神經發育相關通路、273條環境響應通路和185條營養代謝通路的系統分析,繪制了兒童發育障礙的分子網絡圖譜。這一分析揭示了神經發育過程中的關鍵時間窗口和敏感節點,特別是胚胎期神經管形成、胎兒期神經元遷移、出生后突觸修剪和髓鞘形成等關鍵階段。研究表明,這些時期的分子調控網絡異常與發育障礙的發生密切相關。
(2)基因-環境-營養互作網絡
通過整合分析,研究團隊鑒定出523個與兒童發育障礙相關的基因,并將其分類為核心致病基因、易感基因和修飾基因三個層次。這些基因主要富集在神經元分化、突觸形成、軸突導向、神經遞質代謝和膠質細胞功能等生物學過程。研究發現約78%的相關基因存在環境因素響應元件或營養敏感調控區域,表明基因-環境-營養的三維互作在疾病發生中發揮關鍵作用。團隊構建的互作網絡模型顯示,某些環境毒素(如重金屬、內分泌干擾物)和營養因素(如葉酸、維生素D、ω-3脂肪酸)可通過表觀遺傳修飾機制影響關鍵基因的表達,進而干擾神經發育進程。
(3)表觀遺傳調控機制
研究團隊對發育障礙患兒的外周血和動物模型的腦組織進行了表觀遺傳組學分析,發現DNA甲基化、組蛋白修飾和非編碼RNA調控在疾病發生中扮演重要角色。特別是,某些環境因素可通過改變特定基因的甲基化狀態,影響神經元分化和突觸可塑性。為理解環境因素如何"編程"神經發育提供了分子機制,也為早期干預策略的開發指明了方向。團隊發現,某些營養因子(如葉酸、膽堿和DHA)可通過逆轉特定的表觀遺傳改變,潛在地緩解發育異常。
(4)腸-腦軸與微生物組研究
基于近年來微生物組學研究的突破,團隊特別關注了腸-腦軸在兒童發育障礙中的作用。通過整合分析腸道微生物組數據和代謝組學數據,研究人員發現發育障礙兒童的腸道菌群多樣性降低,短鏈脂肪酸產生減少,腸道屏障功能受損。這些改變可能通過多種途徑影響神經發育,包括神經炎癥反應、神經遞質代謝、迷走神經信號傳導和微生物代謝產物直接作用等。研究表明某些天然活性成分可通過調節腸道微生物組平衡,間接改善神經發育和行為表現。
(5)多靶點干預策略
基于上述系統分析,研究團隊篩選了上百種潛在的天然干預物質,包括多種植物多酚、ω-3脂肪酸、益生菌、益生元和常量/微量營養素等。通過網絡藥理學分析,團隊評估了這些物質對發育障礙相關通路的調節潛力和網絡干預效率。體外實驗數據顯示,某些組合配方可能通過多重機制發揮協同作用,包括減輕氧化應激、調節神經炎癥、促進神經營養因子表達、改善線粒體功能和恢復突觸可塑性等。特別是,一些植物源多酚類化合物和特定微量營養素的組合顯示出良好的神經保護作用和行為調節潛力。
(6)早期診斷與個體化干預
研究團隊還致力于開發基于多組學數據的早期診斷標志物系統。通過整合基因組、表觀基因組、代謝組和微生物組數據,正在構建一個多層次的生物標志物網絡,旨在實現發育障礙的早期識別和亞型分類。這一多維診斷系統有望支持個體化干預策略的制定,使干預措施能夠針對不同亞型的分子病理特征進行精準調整。研究表明,早期干預對發育障礙的預后至關重要,因為神經系統的可塑性在生命早期最為顯著。
(7)未來研究方向
1.開展前瞻性隊列研究驗證關鍵生物標志物的預測價值
2.利用神經發育類器官模型評估多組分配方的神經發育調節作用
3.探索基于腸-腦軸的干預策略與傳統行為干預的協同效應
4.研究關鍵發育窗口期的精準營養干預方案
5.開發適合不同發育障礙亞型的個體化干預策略
6.建立家庭-學校-醫療機構聯動的綜合干預體系
3.自身免疫性疾病
自身免疫性疾病如類風濕關節炎、系統性紅斑狼瘡和過敏性疾病等,是免疫系統失調導致的慢性疾病。現有治療方法往往伴隨著嚴重的副作用,且難以實現長期緩解。麥基洗德生物數據系統構建了免疫系統的動態平衡模型,試圖找出能夠精準調節免疫平衡的天然活性成分。
(1)臨床數據驅動的研究方向
麥基洗德團隊在過敏領域擁有豐富的臨床實踐經驗,特別是自主研發的"利敏舒"益生菌產品已在臨床應用中取得顯著成效。生物數據系統整合了來自全國多中心的基層醫療機構的數千例患者的臨床數據,包括消化系統過敏(如牛奶蛋白過敏)、皮膚過敏(如濕疹、蕁麻疹)、呼吸系統過敏(如過敏性鼻炎、哮喘)等多種表現形式。系統分析顯示,約65%的過敏患者同時存在多系統癥狀,這一發現促使團隊將過敏性疾病視為全身性免疫調節紊亂,而非局部問題。通過生物數據系統的整合分析,團隊識別出了不同過敏表型的分子特征和潛在干預靶點。
(2)微生物組-免疫軸的數據整合
研發團隊特別關注微生物組與免疫功能的關聯數據。通過整合臨床樣本的微生物組測序數據、免疫指標和臨床效果,系統構建了一個微生物組-免疫互作網絡模型。這一模型揭示了特定菌群組合與免疫平衡之間的關系,為開發精準的微生態免疫調節策略提供了理論基礎。數據分析顯示,利敏舒中的特定菌株組合能夠通過調節腸道菌群平衡,影響多種免疫參數,包括T輔助細胞亞群比例、調節性T細胞數量、炎癥因子水平和分泌型IgA產生等。這些發現被系統記錄并用于指導產品優化和個性化應用方案設計。
(3)天然活性成分的免疫調節數據庫
作為生物數據系統的核心組成部分,團隊構建了一個包含超過500種天然活性成分免疫調節作用的專業數據庫。通過整合文獻數據、體外實驗結果和公司商業化產品利敏舒的臨床觀察,系統對這些成分的免疫調節機制、有效劑量和安全性進行了系統評估,識別出了一系列具有調節T細胞亞群平衡、抑制過度炎癥反應潛力的植物源活性成分。通過網絡藥理學分析,系統預測了這些成分與免疫相關靶點的相互作用,并根據作用模式進行了分類,為配方優化提供了數據支持。
(4)臨床驗證數據的反饋循環
生物數據系統不僅整合已有知識,還建立了臨床驗證數據的反饋機制。團隊系統收集了利敏舒在不同過敏表現中的歷年臨床效果數據,包括:嬰幼兒牛奶蛋白過敏所致慢性腹瀉的治療研究,總有效率達92.5%;嬰兒慢性濕疹的聯合治療研究,總有效率達95.35%;特應性皮炎的輔助治療研究,疾病復發率從42.86%降至21.43%;兒童變應性咳嗽的聯合治療研究,總有效率達93.67%;常年性過敏性鼻炎的治療研究,癥狀評分顯著降低。這些臨床數據被系統化記錄并反饋到生物數據系統,用于驗證預測模型的準確性,并指導下一代產品的研發方向。
(5)基于數據驅動的產品升級計劃
依托生物數據系統的分析結果,麥基洗德團隊計劃在2025年底完成"利敏舒"產品的升級和配方優化。原來針對所有過敏癥狀的單一產品將演進為針對特定過敏表現的精準系列產品,使干預更為精準和具體。生物數據系統通過分析不同過敏亞型的分子特征和臨床表現,為每種配方的設計提供了數據支持。初步的臨床觀察表明,這種數據驅動的精準化策略能夠進一步提高臨床效果,縮短癥狀改善時間。
(6)未來研究與系統升級
1.擴展數據采集范圍,納入更多自身免疫性疾病類型和患者亞群
2.開發針對不同過敏表現的精準配方系列
3.研究腸道菌群代謝產物與免疫調節的分子機制
4.探索過敏-微生物-營養三維互作網絡
5.建立過敏性疾病早期預警和干預體系
6.開發適合中國人群特點的過敏風險評估工具
7.研究心理因素對免疫功能的影響及其調節策略
開放合作,共建生物醫藥創新生態
麥基洗德堅信,解決人類健康挑戰需要全球科研力量的協作。公司計劃在2027年數據系統徹底建成后,向全球科研機構開放數據資源和分析工具,促進生物醫藥領域的開放創新。這不是簡單的數據共享,而是建立一個互惠互利的創新生態系統。公司將提供標準化的API接口,允許全球高校或科研機構免費、安全地訪問特定數據集和分析工具,合作伙伴可以基于這一平臺開展自己的研究項目,同時貢獻新的數據和見解,形成良性循環。"我們希望這個系統能夠成為連接全球科研力量的橋梁,讓更多研究者能夠基于這一平臺開展創新研究,共同推動生物醫藥科學的發展。"李天琦表示,"麥基洗德愿意成為這一生態系統的建設者和參與者,與全球合作伙伴一起,為人類健康事業貢獻力量。"
1.未來三年目標和計劃
2025年(第一階段進行中)
完成初步生物多樣性數據庫建設,收錄3萬種生物樣本;整合70萬種具備藥用價值的生物活性成分數據;完成百萬級科研文獻的結構化處理與知識提取;啟動1~2家科研機構的試點合作項目(上述提及的量化指標,在第一階段僅作為系統測試、功能驗證和算力測試的基礎數據集和初試樣本)。
2026年(第二階段)
大幅擴充生物多樣性數據庫,目標收錄>15萬種生物樣本;擴展生物活性成分數據庫至300萬種,重點關注多源交叉驗證;整合500萬級科研文獻數據,實現跨語言、跨學科的知識挖掘;完成臨床數據與基礎研究數據的深度整合;開發并優化疾病特異性的預測模型;在神經退行性疾病領域完成2-3個候選配方的動物實驗驗證;在兒童發育障礙領域建立完整的早期篩查與干預體系;在自身免疫性疾病領域推出升級版"利敏舒"相關的系列產品;擴大合作網絡至3~5家國內外研究機構。
2027年(系統全面建成)
實現生物多樣性數據庫的全面覆蓋,目標收錄69萬種以上生物樣本;生物活性成分數據庫擴充至1000萬種以上,建立全球最全面的天然活性成分數據庫;完成2000萬級科研文獻的結構化處理與知識圖譜構建;完成全部數據系統架構建設與功能優化;實現AI輔助的活性成分篩選與配方設計全流程;向全球科研機構開放標準化API接口;在三大疾病領域各產出1-2個具有臨床轉化潛力的研究成果;啟動至少一個多中心臨床研究項目;建立完整的知識產權保護與成果共享機制;形成10家以上研究機構參與的全球合作網絡。
2.三大疾病領域目標
神經退行性疾病領域
2025年完成多組分配方的體外篩選與初步機制研究;2026年完成轉基因小鼠模型的有效性驗證與安全性評估;2027年確定1~2個具有臨床轉化潛力的候選配方,并啟動早期人體試驗準備工作。
兒童發育障礙領域
2025年建立完整的生物標志物評估體系與早期篩查工具;2026年完成基于腸-腦軸的干預方案在類器官模型中的驗證;2027年形成一套綜合干預方案,并在3-5家醫療機構開展臨床觀察研究
自身免疫性疾病領域
2025年完成針對不同過敏表現的精準配方開發與初步臨床驗證;2026年推出升級版"利敏舒"系列產品,覆蓋多種過敏亞型;2027年建立完整的過敏風險評估與精準干預體系,并在全國多中心開展應用研究
通過這一系列目標明確、時間節點清晰的計劃,麥基洗德將逐步實現從數據到知識、從知識到產品、從產品到健康的轉化路徑。我們的使命是深入理解罕見病的分子機制,為這些長期被忽視的疾病群體提供更有效的干預方案。值得強調的是,第一階段的數據收集僅是系統功能驗證的基礎,真正的大規模數據整合將在第二和第三階段實現。這體現了麥基洗德"先建立框架、驗證功能,再逐步擴充數據"的務實發展策略,確保系統架構的穩健性和可擴展性,為后續海量數據的高效處理和深度挖掘奠定堅實基礎。
正如業界前輩屠呦呦所言:"青蒿素是中醫藥獻給世界的一份禮物。"秉承這一傳承創新精神,麥基洗德致力于通過整合全球生物多樣性資源、多組學數據和臨床實踐經驗,探索天然活性成分的治療潛力。我們堅信,科學的價值不在于追逐商業利益,而在于解決人類面臨的健康挑戰。通過系統性地連接自然界的生物智慧與現代醫學科技,我們期望為罕見病患者帶來新的希望,為生物醫藥創新貢獻中國智慧和中國方案。
關于麥基洗德
煙臺麥基洗德生物工程有限公司成立于2017年,總部位于山東龍口,是一家由90后為主的年輕團隊組成的企業,公司成員來自世界各地,專業背景涵蓋數學、計算機科學、生物信息學、細胞與分子生物學、藥理學、藥劑學、病理學、營養學、臨床醫學、生物技術、環境科學、視覺藝術、信息藝術和傳統美術等多個學科。
作為一個新興的創業團隊,麥基洗德以獨特的視角和方法探索生物多樣性及天然活性成分的研究。公司正致力于構建計算生物學、天然產物化學和藥效評估等研發平臺,逐步形成從數據挖掘、活性成分發現到功能驗證的完整研究路徑。公司重視技術創新,科研經費平均占企業利潤比80%以上,并積極尋求與高校、研究機構及醫療機構的合作機會,希望通過開放協作的方式,為生物醫藥領域帶來創新思路。
縱使前路漫漫,我們依然投入全心全靈、不遺余力、不計代價,只為解鎖更多疾病的神秘密碼。在商業利益與科學真理的抉擇中,在短期回報與長遠價值的權衡間,在個體榮譽與集體福祉的天平上,我們始終選擇真理、長遠與眾生。因為我們堅信,自然界的每一種生物、每一個分子,都可能是改變人類命運的關鍵,當青蒿素還沉睡在古老醫書的字里行間,當青霉素尚未從那片意外的霉菌中被發現,世界也曾對這些改變人類命運的物質一無所知,然而,正是那些最初難以理解的探索,往往孕育著最偉大的突破。

